EE. UU. aprueba tratamiento inyectable contra el VIH
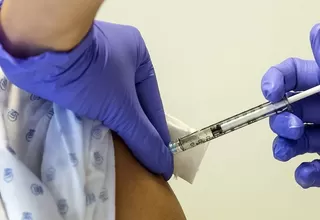
El nuevo tratamiento contra el VIH, desarrollado por Gilead, consiste en dos inyecciones al año

Estados Unidos aprobó un tratamiento innovador que podría transformar la lucha contra el VIH. Se trata de Yeztugo, desarrollado por el laboratorio Gilead, el cual consiste en dos inyecciones al año y representa un avance significativo frente a los métodos tradicionales de prevención.
Hasta ahora, la mayoría de tratamientos profilácticos requerían la toma diaria de pastillas, lo que dificultaba la adherencia sostenida en el tiempo. Con este nuevo esquema semestral, los especialistas esperan un mayor cumplimiento y mejores resultados en poblaciones vulnerables.
La Administración de Alimentos y Medicamentos de Estados Unidos (FDA) confirmó la aprobación del fármaco, el cual estará disponible para adultos y adolescentes que pesen al menos 35 kilogramos.
Lenacapavir: molécula clave en el tratamiento
El tratamiento Yeztugo está basado en la molécula lenacapavir, que ya había sido empleada por Gilead en su terapia antirretroviral Sunlenca, aprobada en 2022. Este compuesto se distingue por su larga duración de acción y su alta eficacia en la supresión del virus.
Daniel O'Day, presidente ejecutivo de Gilead, calificó este avance como “un día histórico” en el camino hacia la erradicación del sida. Expertos del sector coinciden en que esta innovación puede representar un antes y un después en la estrategia mundial de prevención.
Cabe señalar que esta no es la primera vez que se aprueba un inyectable con fines preventivos: en 2021 se autorizó el uso de Apretude, fabricado por ViiV Healthcare. Sin embargo, Yeztugo promete una cobertura más prolongada con solo dos aplicaciones anuales.
Preocupaciones por accesibilidad y costos
A pesar de su potencial impacto positivo, el elevado costo estimado ha generado preocupación. Aunque Gilead no ha publicado el precio oficial, analistas del sector estiman que podría alcanzar los 25.000 dólares anuales en Estados Unidos.
Organizaciones sociales y de salud pública han instado al laboratorio a garantizar la disponibilidad del medicamento en países de bajos recursos, promoviendo licencias para la producción de versiones genéricas.